医疗器械|国际法规|全球产品安全的监管模式
认证网 (2012/11/21 18:39:38) 浏览:976 评论:0
目前,全球各主要医疗器械市场为保证上市的医疗器械产品的安全,均采用以下监管模式:以对产品潜在风险的评估为基础,进行产品分类,根据不同的产品分类,设定相适应的覆盖产品整个生命周期的监督管理要求。也就是说,主管部门制定、发布和实施的对医疗器械从设计到报废整个生命周期各阶段相应的管理要求,是因产品而定的(不同分类等级的产品,各阶段的要求有所区别)。
1. 基于风险评估的医疗器械产品分类
美国是世界上最早提出对医疗器械实行分类管理的国家。从1976年开始,美国将产品结构已经明确的1700余种医疗器械归入16个医学专业组,并相应设置了16个医学专家组。所有医疗器械产品根据风险级别被划分为三个大类,每个医学专家组负责该医学专业领域中器械所属类别的确定。政府将所有分类已确定了的产品列入美国联邦法规21 CFR 862~892部分,并给出每类器械预期用途相关的描述;此外,还建立了分类数据库,企业可以对需要确定分类的医疗器械,通过查询该分类数据库进行核对。此后,每一种新产品出现,政府都会将之列入相应的类别中,以便企业查找。美国的这种管理方法也因此被称为“字典式”的分类方法。
与美国不同,欧盟对医疗器械的分类采用的是“分类原则树”的方法,即依据器械技术设计和制造的潜在危险对人身的伤害程度,将医疗器械分为四个管理类别:I,IIa,IIb,III。欧盟四个等级的分类制度还被GHTF所采纳,通过其协调性指南文件《Principles of Medical Devices Classification》(SG1-N15:2006),提供给其他国家借鉴和参考。日本在其新修订的《药事法》中,在原来四个级别划分的基础上,按照危险程度,将医疗器械的分类调整为三种。我国医疗器械监督管理法规中明确规定,医疗器械按产品应用时的安全性控制程度分为三类,同时,结合公布《医疗器械分类目录》,并以分类目录优先的原则,实施医疗器械的分类管理。
通常,各国在通过潜在风险评估而进行医疗器械分类的过程中,主要考虑的因素包括器械作用于人体的时间、使用的部位、侵入人体的程度、对局部还是全身的作用等。例如,侵入式器械常被认为较非侵入式器械而言有着更高的潜在风险。所以,那些作用和接触于人体时间长、影响人体重要器官(例如心脏、主动脉)和对人体有着全身作用的器械,往往因其较高的潜在风险而被列入较高等级的管理分类。
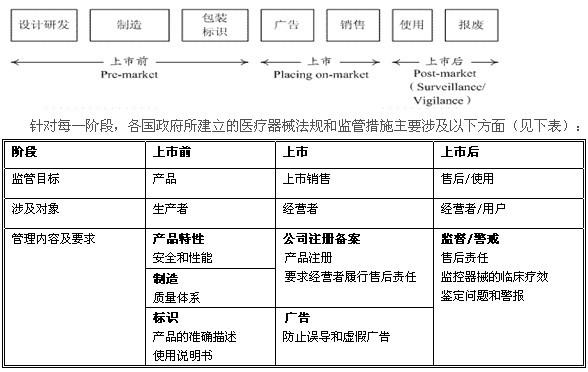
2. 覆盖产品整个生命周期的医疗器械监管要求
现阶段,全球主要医疗器械市场的政府均建立了较为完善的医疗器械法规体系,从而实现对医疗器械产品整个生命周期的监管。根据产品生命周期,医疗器械的监管可划分为三个阶段:上市前、上市和上市后(见下图):
1. 基于风险评估的医疗器械产品分类
美国是世界上最早提出对医疗器械实行分类管理的国家。从1976年开始,美国将产品结构已经明确的1700余种医疗器械归入16个医学专业组,并相应设置了16个医学专家组。所有医疗器械产品根据风险级别被划分为三个大类,每个医学专家组负责该医学专业领域中器械所属类别的确定。政府将所有分类已确定了的产品列入美国联邦法规21 CFR 862~892部分,并给出每类器械预期用途相关的描述;此外,还建立了分类数据库,企业可以对需要确定分类的医疗器械,通过查询该分类数据库进行核对。此后,每一种新产品出现,政府都会将之列入相应的类别中,以便企业查找。美国的这种管理方法也因此被称为“字典式”的分类方法。
与美国不同,欧盟对医疗器械的分类采用的是“分类原则树”的方法,即依据器械技术设计和制造的潜在危险对人身的伤害程度,将医疗器械分为四个管理类别:I,IIa,IIb,III。欧盟四个等级的分类制度还被GHTF所采纳,通过其协调性指南文件《Principles of Medical Devices Classification》(SG1-N15:2006),提供给其他国家借鉴和参考。日本在其新修订的《药事法》中,在原来四个级别划分的基础上,按照危险程度,将医疗器械的分类调整为三种。我国医疗器械监督管理法规中明确规定,医疗器械按产品应用时的安全性控制程度分为三类,同时,结合公布《医疗器械分类目录》,并以分类目录优先的原则,实施医疗器械的分类管理。
通常,各国在通过潜在风险评估而进行医疗器械分类的过程中,主要考虑的因素包括器械作用于人体的时间、使用的部位、侵入人体的程度、对局部还是全身的作用等。例如,侵入式器械常被认为较非侵入式器械而言有着更高的潜在风险。所以,那些作用和接触于人体时间长、影响人体重要器官(例如心脏、主动脉)和对人体有着全身作用的器械,往往因其较高的潜在风险而被列入较高等级的管理分类。
2. 覆盖产品整个生命周期的医疗器械监管要求
现阶段,全球主要医疗器械市场的政府均建立了较为完善的医疗器械法规体系,从而实现对医疗器械产品整个生命周期的监管。根据产品生命周期,医疗器械的监管可划分为三个阶段:上市前、上市和上市后(见下图):
相关内容:








